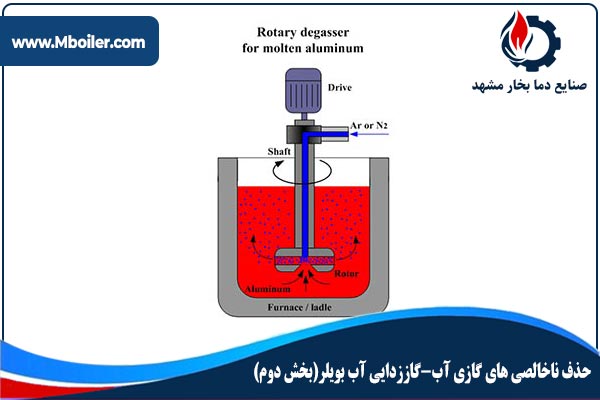
برای گاززدایی آب بویلر و حذف برخی از گازهای محلول در آب آن می توان از روش های شیمیایی نیز استفاده کرد.
در این روش بسته به اینکه حذف چه گازی مورد نظر است، ماده شیمیایی افزوده می شود و نیز در شرایط عملیاتی از قبیل PH و دما به دلیل موثر بودن حذف شیمیایی تفاوت خواهد کرد.
۲-۲-۱۲ روش های شیمیایی حذف گازها در دیگ بخار (گاززدایی آب بویلر)
در این بخش گاززدایی آب بویلر با حذف شیمیایی چند گاز مورد بررسی قرار می گیرد.
الف- حذف اکسیژن (O۲):
اکسیژن محلول در آب یکی از موثرترین عوامل خورندگی فلزات است که اشکالات زیادی بوجود می آورد. شدت خوردگی در لوله ها بستگی به غلظت اکسیژن محلول، دمای سیستم و ph آب دارد.
عمل خوردگی توسط اکسیژن در سیستم های بسته تا مصرف کامل اکسیژن ادامه می یابد، ولی در سیستم های باز عمل خوردگی می تواند دائمی باشد، خوردگی توسط اکسیژن، آبله گونه است که با ایجاد دمل های برجسته ای روی سطوح دیده می شود و با ادامه خوردگی، این سوراخ ها عمیق تر می گردد، در نهایت منجر به سوراخ شدن لوله یا دستگاه می شود.
در دستگاه های هواگیری آب سرد و گرم می توانند مقدار اکسیژن موجود در آب را تا حدود ۵ ppb کاهش دهند، ولی برای حذف کامل اکسیژن نیاز به استفاده از روش های شیمیایی است.
مواد شیمیایی مورد استفاده برای حذف اکسیژن از آب بویلر
سدیم سولفوریت (Na۲SO۳) هیدرازین (N۲H۴)، سدیم هیدروسولفیت (NaHSO۳)، سدیم هیدروفسفیت ( Na۲ HPO۳ ) و تانن از جمله مواد شیمیایی برای حذف اکسیژن می باشند.
برای دیگ های بخار با فشار کمتر از ۷۰ اتمسفر سدیم سولفیت ماده شیمیایی مناسبی است. واکنش شیمیایی بین سدیم سولفیت و اکسیژن را به صورت زیر می توان نشان داد:
۲Na۲ SO۳ +O۲“۲Na۲ SO۴
برای حذف هر PPm اکسیژن حدود ۸PPm سدیم سولفیت مورد نیاز است، ولی به خاطر وجود ناخالصی های دیگر و نیز هدر رفتن آب به ازای هر PPm اکسیژن از PPm10 سدیم سولفیت استفاده می شود و برای اطمینان از حذف کامل اکسیژن لازم است همیشه مقدار سدیم سولفیت به صورت مازاد در آب باقی بماند.
میزان مازاد سدیم سولفیت به عواملی مانند روش تزریق، محل تزریق، غلظت اکسیژن محلول و تغییر غلظت آن در آب تغذیه دیگ های بخار بستگی پیدا می کند.
اضافه نمودن سدیم سولفیت به آب به روش پیوسته توصیه می شود. روش متناوب رایج نیست و تنها گاهی در دیگ های دارای فشار کم مورد استفاده قرار می گیرد. برای افزایش سرعت واکنش بین سدیم سولفیت و اکسیژن می توان به موارد زیر توجه کرد:
برای افزایش سرعت واکنش بین سدیم سولفیت و اکسیژن می توان به موارد زیر توجه کرد:
-تنظیم PH محیط بین ۹ تا ۱۰ به منظور داشتن سریع ترین واکنش.
-استفاده از یون های فلزات واسطه دو ظرفیتی مانند: کبالت، نیکل، مس و منگنز بعنوان کاتالیست (این کاتالیست ها همراه با سدیم سولفیت به بازار عرضه می شوند.)
شکل
-در فشارهای بالاتر از ۷۰ اتمسفر برای حذف اکسیژن از هیدرازین (N۲H۴ ) استفاده می شود. از سدیم سولفیت در فشار های بالا به دو دلیل استفاده نمی شود.
-افزایش کل محلول (T.D.S) در آب که پدیده مضری برای دیگ های بخار می باشد.
-احتمال زیاد تجزیه سدیم سولفیت به گازهای خورنده مانند SO۲ وH۲S در فشارهای بالا.
هیدرازبین برای اولین بار در جنگ جهانی دوم توسط، دانشمند آلمانی spilittgeler مورد آزمایش قرار گرفت واکنش این ماده اکسیژن بصورت زیر است:
N۲H۴(NH۲-NH۲)+O۲“۲H۲O+N۲
از مزایایی مصرف هیدرازبین این است که استفاده از آن سبب افزایش کل مواد محلول (T.D.S) نمی شود، چون واکنش آن با اکسیژن ماده جامدی تولید نمی کند.
هر PPm از هیدرازبین قادر به حذف ۱ppm اکسیژن است ولی در عمل معمولا ۵/۱ تا ۲ برابر غلظت اکسیژن، هیدرازبین تزریق می شود.
افزایش هیدرازبین باید با دقت کامل انجام شود, زیرا این ماده در فشار های بالا تجزیه می شود و آمونیاک و نیتروژن تولید می کند.
۳N۲H۴+۴H۲O” N۲+۴N۲H۴ O H
آمونیاک تولید شده در حضور اکسیژن می تواند باعث خوردگی اتصالات مسی و یا آلیاژهای مس شود. برای جلوگیری از ازدیاد آمونیاک در آب دیگ بخار توصیه می شود که مقدار هیدرازبین باقی مانده در آب از ۰/۱ppm تجاوز نکند.
آمونیاک می تواند دی اکسید کربن میعان یافته موجود در آب را که خاصیت خورندگی زیادی دارد، خنثی کند، که برای سیستم مطلوب است.
هیدرازبین ماده ای است سمی که تا حدودی قابلیت انفجار دارد.
به همین دلیل برخی از سازندگان، هیدرازبین فسفردار را به بازار عرضه کرده اند که باعث بی خطر شدن آن می شود. ضمنا فسفر موجود در آن در جهت جلوگیری رسوبات به جداره ها موثر واقع می شود.
ب) حذف هیدروژن سولفید (H۲ s ):
هیدروژن سولفید می تواند از تجزیه مواد آلی گوگرددار و یا از سولفیت ها و سولفات های معدنی بوجود آید. مقدار هیدروژن سولفید آزاد در آب بستگی به PH دارد. با کاهش PH، میزان هیدروژن سولفید آزاد در آب بیشتر می شود. جدول زیر چگونگی توزیع هیدروژن سولفید را نسبت به تغییر PH نشان می دهد:
جدول۱۲-۱ .تغییرات درصد H۲ s آزاد به کل H۲ s موجود در آب با PH
۹ ۸ ۷ ۶ ۵ | PH |
۰/۵ ۵/۲ ۳۳ ۸۲ ۹۸ | درصد H۲ s آزاد به کل H۲ s موجود در آب |
معمولا برای حذف هیدروژن سولفید از روش هوادهی استفاده می شود و برای آنکه بازده این روش بالا باشد، ابتدا PH آب را با افزودن CO۲ یا S H۲O به آب کاهش می دهند تا درصد H۲ s گازی شکل در آب افزایش یابد و سپس به روش هوادهی H۲ s گازی شکل را از آب خارج می کنند.
با روش هوادهی غلظت H۲ s را تا حدود ۱PPmمی توان کاهش داد. روش دیگری که برای حذف H۲ s بکار می رود روش شیمیایی تزریق گاز کلر است. در این روش واکنش زیر صورت می گیرد،
H۲ S+4CL+4H۲O”H۲SO۴+۸HCL
برای حذف هر واحد غلظت از هیدروژن سولفید، ۸ واحد غلظت گاز کلر لازم است.
پ)حذف آمونیاک (NH۳):
حلالیت آمونیاک در آب زیاد است و حتی در فشار جزئی کم ، آمونیاک به میزان زیادی در آب حل می شود، لذا حذف آمونیاک توسط روش هوادهی کار مشکلی است.
در آب های صنعتی، میزان آمونیاک کم است. بنابراین استفاده از روش هوادهی مقرون به صرفه نیست، ولی در مورد تصفیه فاضلاب ها که مقدار آمونیاک زیاد است، برای کاهش آمونیاک می توان از روش هوادهی استفاده نمود.
مقداری از آمونیاک در آب بصورت ترکیبی (یون آمونیمNH+۴) و مقداری از آن به صورت آزاد است. که رابطه تعادلی را می توان به صورت زیر نشان داد:
NH۳+H۲O” NH+۴+OH–
گاززدایی آب بویلر – حذف آمونیاک
درصد آمونیاک آزاد در آب با توجه به تعادل فوق برابر است با:
به صورت آزاد با توجه به ثابت تعادل آب KW و ثابت تعادل آمونیاک KL و جای گذاری در رابطه فوق می توان نوشت:
رابطه فوق نشان می دهدکه درصد آمونیاک آزاد در آب ارتباط تنگاتنگی با PH دارد. افزایش PH سبب کاهش H+ و در نتیجه باعث آمونیاک آزاد می شود. حذف آمونیاک به روش شیمیایی با افزودن گاز کلر به آب انجام می شود. آمونیاک با کلر طی واکنش های زیر ترکیب می شود.
۲NH۳+۲CL۲→۲NH۲CL+2HCL
NHCL+ CL۲→NCL۳+HCL
NH۲CL+ NHCL۲→N۲+۳ HCL
PH آب تعیین کننده نوع مواد تولید شده است به طوری که در حدود ۸.۵ منوکلروآمین و PH تا ۴.۵ دی کلروآمین و در های کمتر تری کلروآمین تولید می شود.
فرایند زدودن آمونیاک توسط کلر کند است و حدود دو ساعت زمان لازم است تا در PH هفت الی نه واکنش تکمیل شود و در نهایت گاز نیتروژن و اسیدکلریدریک تولیدمی شود. برای اکسیداسیون هر PPM آمونیاک مقدار ۶PPM گاز کلر لازم است.
ت )حذف کلر:
CL2 کلر در آب های طبیعی به طور معمول وجود ندارد ولی در تصفیه مقدماتی برای اکسیداسیون موادآلی و ضدعفونی کردن آب، کنترل بو، کنترل خورندگی H2S کنترل رشد لجن و اکسیداسیون فروسولفات مورد استفاده قرار می گیرد.
البته وجود یون کلرین به دلیل خاصیت اکسیدکنندگی قوی موجب کاهش کارایی رزین های تعویض کننده یون می گردد. درضمن وجود کلر آزاد در آب مورد استفاده در صنایع غذایی باعث تغییر مزه در مواد کنسرو شده و مواد یخ زده و خوردگی فلز ظروف کنسرو می گردد.
بنابراین لازم است که قبل از ورود آب به واحدهای مبادله یونی و صنایع غذایی، در روش شیمیایی، فرایند حذف کلر مورد استفاده قرار گیرد.
روش های شیمیایی حذف کلر عبارتند از:
الف) کربن فعال :
به دو روش می توان از کربن فعال برای حذف کلر از آب استفاده کرد.
-با تزریق پودر زغال فعال در مخزن های لخته سازی و در نتیجه ترکیب کلر با پودر زغال.
-با انتخاب زغال فعال بعنوان دانه های موجود در بستر فیلتر، که در این صورت با عمل فیلتراسیون آب و عبور آب از بستر زغالی کلر آن جذب می شود.
عمل جذب کلر توسط زغال فعال، هم توسط مکانیسم جذب فیزیکی و هم جذب شیمیایی انجام می شود.
”
جذب شیمیایی که بصورت واکنش فوق صورت می گیرد، نشان می دهد که زغال با گذشت زمان تمام می شود و باید هر چند مدت تزریق پودر زغال به مخازن لخته سازی انجام گیرد و بسترهای زغالی فیلترها تعویض شود. شش گرم کلر را توسط یک گرم کربن می توان حذف نمود.
ب)سدیم سولفیت:
با تزریق محلول سدیم سولفیت به آب، طی واکنش زیر کلر حذف می گردد:
Na۲SO۳+CL۲+H۲O”Na۲SO۴+۲HCL
برای حذف یک گرم کلر آزاد در آب احتیاج به ۵۵/۳ گرم سدیم سولفیت متبلور است.
ج) سدیم بی سولفیت:
سدیم بی سولفیت نیز طبق واکنش زیر سبب حذف کلر آزاد می شود. ولی حذف کلر به طور صددر صد انجام نمی شود.
۲ Na H SO۳+۲CL+2 H۲O” Na۲SO۴+۴HCL+ H۲ SO۴
د)کلسیم سولفیت :
طبق رابطه زیر کلسیم سولفیت می تواند با کلر آزاد واکنش دهد و سبب حذف آن شود.
Ca SO۳+CL۲+ H۲O” Ca SO۴+۲ HCL
از کلسیم سولفید بعنوان دانه های بستر فیلتر استفاده می شود و با عبور آب از فیلتر کلر آزاد جذب می شود. از مزایای استفاده از کلسیم سولفیت، عدم احتیاج آن به دستگاه تزریق است.
همچنین در فیلترهایی که از کلسیم سولفید استفاده می شود نسبت به فیلترهای دارای بستر زغالی، سرعت عبور آب می تواند زیاد باشد و این امر سبب کوچکتر شدن فیلترهای کلسیم سولفیت نسبت به فیلترهای زغالی است.
گران بودن کلسیم سولفیت از مشکلات این روش می باشد. هر واحد آن حدودا ده برابر قیمت هر واحد سدیم سولفیت است.
ه)گاز سولفورو:
از گاز دی اکسید کربن گوگرد و یا سولفورو نیز می توان برای حذف کلر آزاد آب استفاده کرد. هر ۰.۶ گرم گاز خالص سولفورو قادر به حذف یک گرم کلر می باشد.
SO۲+ CL۲+۲ H۲O”2 HCL+ H۲ SO۴
علاوه بر موارد فوق که می توانند با کلر آزاد وارد واکنش شوند، می توان با قرار دادن آب در مخازن سرباز به مدت نسبتا زیاد، مقدار کلر آزاد در آب را کاهش داد.
برای کسب اطلاعات بیشتر، مقالات مربوطه را مطالعه فرمایید: