به منظور درک بهتر خواص بخار، مناسب است که ساختار مولکولی و اتمی بخار و بدنبال آن آب و یخ شناخته شود.
یک مولکول، کوچکترین عضو تشکیل دهنده ماده است که می تواند با حفظ تمامی خواص شیمیایی آن ماده وجود داشته باشد. مولکول ها خود از عناصر کوچک تری بنام اتم تشکیل شده اند که مشخص کننده عناصر پایه نظیر اکسیژن یا هیدروژن هستند.
ترکیب خاص مولکول ها با یکدیگر منجر به تشکیل ماده مرکب می شود. این مواد با فرمول های شیمیایی نظیر H۲O که دارای مولکول هایی مرکب از ۲ اتم هیدروژن و یک اتم اکسیژن می باشد، نشان داده می شوند.
از آنجائی که هیدروژن و اکسیژن در بسیاری از ترکیبات موجود در کره زمین وجود دارند، آب نیز بسیار در دسترس و ارزان می باشد. کربن نیز المان دیگری از مواد است که در بسیاری از ترکیبات بنیادی به چشم می خورد. بسیاری از مواد می توانند در سه حالت جامد، مایع و گاز وجود داشته باشند که از آن ها بعنوان فاز نام برده می شود.
در مورد H۲ O، فازهای مختلف با عناوین یخ، آب و بخار اسم گذاری شده است.
-نقطه سه گانه بخار
فازهای گاز، مایع و جامد فقط در یک نقطه ثابت دما و فشار می توانند با هم در تعادل باشند که به نقطه سه گانه معروف است. نقطه سه گانه آب که تمامی فازها در حال تعادل می باشند، در دمای ۲۷۳.۱۶K فشار مطلق ۰.۰۰۶۱۱۲ bar رخ می دهد.
این فشار بسیار نزدیک به خلاء مطلق است و در صورت کاهش بیشتر فشار در این دما، یخ مستقیما به بخار تبدیل می شود.
-یخ
در فاز جامد (یخ)، تمامی مولوکول ها در یک شبکه بهم پیوسته قفل شده و فقط ارتعاش می نمایند. حرکت مولکولی در این فاز، بسیار نزدیک به هم بوده و کمتر از اندازه یک مولکول می باشد.
افزایش حرارت باعث افزایش و جدا شدن تعدادی از مولکول ها از مولکول های مجاور گشته و به دنبال آن تغییر حالت جامد به مایع و عمل ذوب شروع می گردد.
(این شرایط در دمای صفر درجه و مستقل از فشار است). مقدار انرژی که باعث شکسته شدن پیوندهای بین مولکولی و تغییر فاز، بدون افزایش دمای یخ می گردد به آنتالپی ذوب معروف است.
این تغییر فاز برگشت پذیر بوده و در صورت آزاد شدن همان مقدار انرژی به محیط اطراف، قابل انجام است.
چگالی اکثر مواد در هنگام ذوب کاهش می یابد ولی در مورد H۲O این امر برعکس بوده، بطوری که افزایش چگالی آب نسبت به یخ مشاهده می شود. (دلیل شناور ماندن یخ بر روی آب همین مساله می باشد).
-آب
در فاز مایع مولکول ها آزادانه حرکت کرده ولی همچنان به علت نیروی جاذبه بین مولکولی در فاصله کمی حرکت می نمایند. افزایش حرارت باعث افزایش حرکات بین مولکولی و افزایش دما تا دمای جوش می گردد.
-آنتالپی آب، آنتالپی مایع یا گرمای محسوس آب (hr)
این پارامتر میزان انرژی لازم جهت افزایش دمای آب از میزان ۰۰c تا دمای جوش می باشد. در دمای صفر درجه سانتی گراد، آنتالپی آب صفر در نظر گرفته شده و بنابراین تمامی دماهای دیگر با توجه به این مرجع سنجیده می شود.
علت استفاده از واژه گرمای محسوس تغییر دمای محسوس آب با افزایش انرژی می باشد. در فشار اتمسفریک (۰ barg)، در دمای ۱۰۰۰c به جوش آمده و به منظور گرمایش یک کیلوگرم آب صفر درجه تا دمای صد درجه، مقدار ۴۱۹ kj/kg۰c انرژی لازم است.
-بخار
با افزایش دمای آب و رسیدن به دمای جوش، برخی از مولکول ها دارای انرژی جنبشی کافی می گردند، به طوری که می توانند به فضای بالای سطح مایع فرار کرده و جدا شوند. افزایش حرارت باعث افزایش تعداد مولکول های فراری و سپس تشکیل حباب های بخار در داخل مایع می شود که در سطح آب می ترکند.
با در نظر گرفتن ساختار مولکولی، فاز مایع و بخار و فاصله زیاد مولکول ها در فاز بخار، دیده می شود که چگالی فاز بخار بسیار کمتر از چگالی آب است، بنابراین فضای بالای مایع به سرعت از مولکوله ای با چگالی پایین تر انباشته می شود.
وقتی تعداد مولکول هائی که آب را ترک می نمایند، از مولکول هائی که دوباره به آن برمی گردند بیشتر شود، آب بصورت آزاد شروع به تبخیر می نماید. در این نقطه آب به دمای جوش یا دمای اشباع خود می رسد، چرا که با انرژی حرارتی اشباع شده است.
افزایش بیشتر حرارت با ثابت ماندن فشار، باعث تغییر دمای مضاعف نشده و فقط منجر به تشکیل بخار می گردد. دمای آب جوش و بخار اشباع در فشار ثابت یکسان بوده، ولی میزان انرژی واحد جرم در فاز بخار بسیار بیشتر از فاز مایع است. در فشار اتمسفریک دمای اشباع ۱۰۰۰c است.
با این وجود، در صورت افزایش فشار، امکان انتقال در فشار حرارت بیشتر بدون تغییر مایع وجود دارد. بنابراین افزایش فشار باعث آنتالپی مایع و دمای اشباع می گردد. رابطه بین اشباع و فشار به منحنی اشباع بخار معروف است(شکل۱، ۲، ۲)
آب و بخار در هر فشاری روی منحنی فوق بصورت مشترک و در شرایط دمای اشباع وجود دارند. بخاری که در شرایط دمائی بالاتر از این منحنی قرار دارد به بخار سوپرهیت معروف است.
-مقدار اختلاف دمای بالاتر از دمای اشباع به درجه سوپرهیت معروف است.
جدول فشار بخار آب در دماهای مختلف
| دما (°C) | فشار بخار (kPa) |
|---|---|
| ۰ | ۰.۶۱۱ |
| ۱۰ | ۱.۲۲۸ |
| ۲۰ | ۲.۳۳۷ |
| ۳۰ | ۴.۲۴۳ |
| ۴۰ | ۷.۳۸۲ |
| ۵۰ | ۱۲.۳۴۴ |
| ۶۰ | ۱۹.۹۲۵ |
| ۷۰ | ۳۱.۱۶۸ |
| ۸۰ | ۴۷.۳۷۱ |
| ۹۰ | ۷۰.۱۱۵ |
| ۱۰۰ | ۱۰۱.۳۲۵ |
این جدول فقط برای دماهای بین ۰ تا ۱۰۰ درجه سانتیگراد ارائه شده است.
برای دماهای بالاتر از ۱۰۰ درجه سانتیگراد، میتوانید از نمودارهای فشار بخار آب استفاده کنید.
همچنین میتوانید از نرمافزارهای محاسباتی برای محاسبه فشار بخار آب در دماهای مختلف استفاده کنید.
نکاتی در مورد استفاده از جدول:
- فشار بخار آب با دما افزایش مییابد.
- در دمای ثابت، فشار بخار آب با ارتفاع کاهش مییابد.
- فشار بخار آب اشباع به فشار محیط بستگی ندارد.
اگر بخار خروجی از دیگ به میزان تولیدی باشد و بتواند آزادانه جریان یابد، افزایش حرارت باعث افزایش نرخ تولید بخار می شود، ولی اگر بخار خروجی محدود نگاه داشته شود و همزمان انرژی حرارتی نیز افزوده گردد، انرژی ورودی به دیگ بیشتر از انرژی خروجی شده که باعث افزایش فشار و بدنبال آن افزایش دمای دیگ می گردد چرا که دمای اشباع ارتباط مستقیم با فشار دارد.
-به آب در شرایط زیر منحنی، آب زیر اشباع گفته می شود.
-آنتالپی تبخیر یا گرمای نهان ( hrg) آب
این پارامتر مقدار انرژی لازم جهت تغییر فاز آب در حال جوش به بخار می باشد. در این فرآیند هیچ گونه افزایش دمایی رخ نداده و تمام انرژی صرف تغییر فاز می شود. اصطلاح قدیمی گرمای نهان بعلت عدم تغییر دما با وجود افزایش انرژی می باشد، ولی اصطلاح مناسب تر گرمای تبخیر است.
همانند تغییر فاز یخ به آب، فرآیند تبخیر نیز قابل برگشت است. در فرآیند چگالش، میعان یا کندانس، همان مقدار انرژی که در تولید بخار صرف شده است به محیط اطراف پس داده می گردد. این پدیده در هر زمان که بخار با سطوح سردتری در تماس قرار گیرد، اتفاق می افتد.
این مقدار انرژی، انرژی موثر و مفید بخار در کاربردهای حرارتی است، زیرا دقیقا میزانی از انرژی است که هنگام تبدیل بخار به کندانس آزاد می شود.
-آنتالپی بخار اشباع یا انرژی کل بخار اشباع(hg)
این پارامتر انرژی کل بخار اشباع بوده و به راحتی از مجموع آنتالپی آب و آنتالپی تبخیر به دست می آید:
که در آن: آنتالپی (و دیگر خواص) بخار اشباع به راحتی با استفاده از جداول تجربی موجود که به جداول بخار اشباع معروف است به دست می آیند.
-جدول بخار اشباع
جدول بخار اشباع، بیان کننده خواص مختلف بخار در فشارهای متفاوت است. این اعداد از آزمایشات واقعی منتج شده اند. جدول ۱ ، ۲ ، ۲ نشان دهنده خواص بخار اشباع در فشار اتمسفریک یا ۰ bar g می باشد.

-مثال۱ ، ۲ ، ۲:
در فشار اتمسفریک، آب در دمای ۱۰۰۰c به جوش می آید و انرژی لازم جهت گرمایش یک کیلوگرم آب از دمای ۰۰c تا ۱۰۰۰c برابر ۴۱۹ kj/kg می باشد. بنابراین آنتالپی ویژه آب در فشار ۰ bar g و دمای ۱۰۰۰c برابر ۴۱۹ kj/kg می باشد.
هم چنین انرژی لازم جهت تبخیر یک کیلوگرم آب صد درجه به یک کیلوگرم بخار صد درجه برابر ۲۲۵۷ Kj می باشد. بنابراین در فشار ۰ bar g آنتالپی محسوس تبخیر برابر Kj 2257 می باشد.
آنتالپی کل بخار در فشار ۰ bar g برابر است با : ۴۱۹ + ۲۲۵۷ = ۲۶۷۶KJ/Kg
بخار در شرایط اتمسفریک دارای موارد استفاده محدود می باشد زیرا نمی تواند در طول لوله به سمت نقطه مصرف حرکت نماید.
توجه : با دقت در نسبت فشار و حجم بخار اشباع دیده می شود که با افزایش، حجم مخصوص کاسته می گردد. به همین علت مناسب است که بخار با فشار حداقل ۷bar درون دیگ تولید گردد. تولید بخار در فشار نسبتا بالا موجب حفظ قطر لوله ها و شیرآلات در اندازه های معقول می گردد.
شکل ۲ ، ۲ ، ۲ نشان دهنده رابطه حجم مخصوص و فشار می باشد. دیده می شود که تغییرات زیاد حجم مخصوص در فشارهای پایین تر اتفاق می افتد و در فشارهای بالاتر (مثلا بالاتر از ۷bar) تغییرات حجم مخصوص کمتر می باشد.
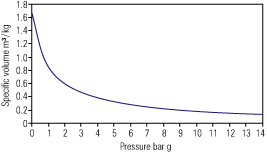
با دقت در جداول بخار ۲ ، ۲ ، ۲ می توان حجم مخصوص و بقیه خواص بخار اشباع را مشاهده نمود.
در فشار bar ، دمای اشباع آب ۱۷۰ ۰c می باشد. همانطور که دیده می شود، آنتالپی آب در این فشار برابر ۷۲۱ Kj/kg می باشد، که بیشتر از آنتالپی آب در فشار اتمسفریک (۴۱۹ Kj/kg ) است.
در مقابل انرژی حرارتی مورد نیاز جهت تبخیر آب در فشار ۷bar کمتر از این انرژی در فشار اتمسفریک است و نشان دهنده کاهش آنتالپی مخصوص تبخیر با افزایش فشار می باشد. با این حال، از آنجائیکه حجم مخصوص تبخیر با افزایش فشار می باشد.
با این حال، از آنجائیکه حجم مخصوص نیز با افزایش فشار کاهش می یابد، مقدار انرژی حرارتی قابل حمل توسط حجم ثابتی از بخار با افزایش فشار زیادتر می شود.
-میزان خشکی بخار
در صورت تبخیر کامل آب در فشار ثابت، بخار کاملا خشک اشباع حاصل خواهد شد، در عمل بویلرهای صنعتی امروزی به ندرت قادر به تامین بخار کاملا خشک بوده و بخار حاصل معمولا دارای قطرات آب می باشد.
در حقیقت، به علت تلاطم و آشفتگی داخل دیگ که خود به علت ترکیدن حباب های بخار در سطح آب دیگ است، فضای بالای سطح آب حاوی مخلوطی از بخار و آب است.
در دیگ های Fire-Tube که در آن ها حرارت آب اعمال شده و بخار در تماس مستقیم با سطح آب است، حدود ۵% آب در بخار خروجی وجود خواهد داشت. در این صورت گفته می شود که بخار تولیدی ۹۵% خشک بوده و یا دارای ضریب خشکی ۹۵% می باشد.
آنتالپی واقعی تبخیر در بخار مرطوب برابر حاصل ضرب ضریب خشکی (x)در آنتالپی تبخیر بخار خشک (hfg) است که از جدول بخار قابل اکتساب است. بنابراین بخار مرطوب دارای انرژی حرارتی کمتری نسبت به بخار اشباع است.
از آنجائی که حجم آب بسیار کمتر از حجم بخار است، قطرات آب داخل بخار حجم ناچیزی را اشغال می نمایند و بنابراین حجم مخصوص بخار مرطوب نیز کمتر از بخار اشباع است. معادله زیر نشان دهنده آنتالپی واقعی تبخیر است.
-مثال۲ ، ۲ ، ۲:
بخار در فشار ۶barg دارای ضریب خشکی ۰.۹۴ بوده و بنابراین دارای ۹۴% آنتالپی بخار اشباع در فشار ۶barg است. محاسبات زیرین با توجه به جدول بخار انجام شده است:
-دیاگرام فازی بخار
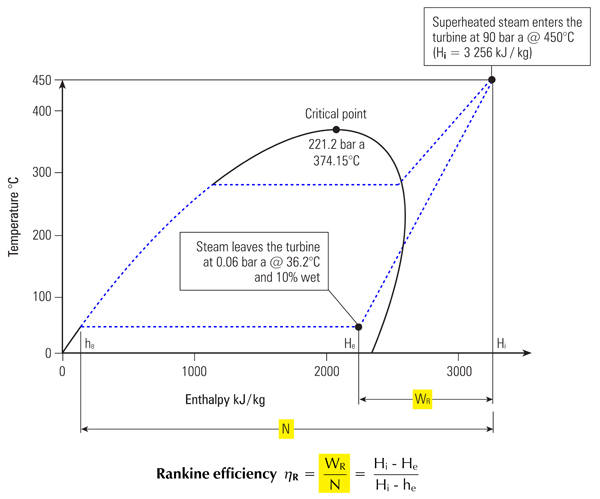
اطلاعات موجود در جدول بخار می تواند با نمودار گرافیکی بیان گردد. شکل ۳، ۲، ۲ نشان دهنده ارتباط بین آنتالپی و دما در فشارهای مختلف که به دیاگرام فاز معروف است.
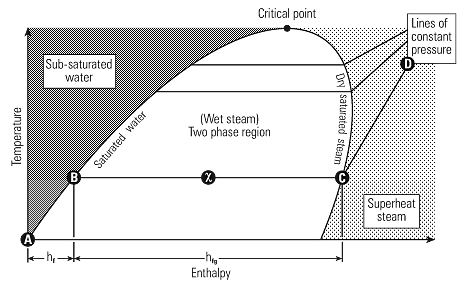
آب با گرم شدن از دمای ۰ ۰c تا دمای اشباع، منحنی مایع اشباع را دنبال نموده تا تمامی آنتالپی مایع یاhr راجذب نماید.(A-B).
با افزایش انتقال حرارت تغییر فاز به بخار اشباع اتفاق افتاده و افزایش آنتالپی در طی فرآیند دما ثابت رخ خواهد داد.(B-C) و hfg.
با افزایش خشکی مخلوط آب و بخار، شرایط مخلوط از خط آب اشباع به سمت بخار اشباع حرکت می کند. بنابراین درست در نقطه میانی این دو حالت، ضریب خشکی برابر ۰.۵ بوده و در خط بخار اشباع، بخار صد در صد خشک خواهد بود.
با ادامه گرمایش بخار از نقطه بخار اشباع، دمای بخار شروع به افزایش در فاز سوپرهیت(C-D) می نماید. منحنی های بخار اشباع بوجود آورنده ناحیه ای هستند که مخلوط بخار و آب در کنار هم موجود بوده و اصطلاحا بخار مرطوب است.
در ناحیه سمت چپ خط مایع اشباع فقط آب و در ناحیه سمت راست بخار اشباع، بخار سوپر هیت موجود می باشد.
نقطه تلاقی منحنی های مایع اشباع و بخار اشباع به نقطه بحرانی معروف است. با دقت در منحنی دیده می شود که با افزایش فشار، آنتالپی تبخیر کاهش می یابد تا اینکه در نقطه بحرانی به صفر می رسد و بنابراین در نقطه بحرانی آب مستقیما به بخار تبدیل می شود.
در قسمت بالای منحنی فقط گاز وجود دارد که در این قسمت مولکول ها بصورت کاملا آزاد در حال حرکت می باشند.
دمای نقطه بحرانی بالاترین دمایی است که آب می تواند داشته باشد و افزایش بیشتر فشار بالای این نقطه منجر به تغییر فاز نخواهد شد.
شرایط نقطه بحرانی در دمای ۳۷۴.۱۵۰cو۲۲۱.۲barg می باشد. در فشارهای بالاتر، بخار بعنوان فوق بحرانی شناخته شده و نقطه جوش مشخصی ندارد.
-بخار فلاش
بخار فلاش معمولا در بخار آزاد شده از ونت تانک ها و مخازن کندانس و یا خطوط کندانس خروجی از تله های بخار به چشم می خورد.
این نوع بخار بدون افزایش حرارت به آب و مستقیما در اثر تقلیل فشار آب از فشار بالاتر به پایین تر تشکیل می گردد (در واقع درصدی از آب به بخار تبدیل می شود) (شکل۴ ، ۲ ، ۲)
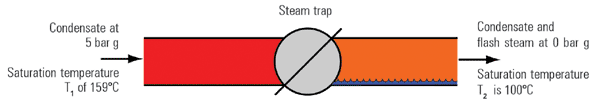
یک کیلوگرم کندانس در فشار ۵barg و دمای اشباع ۱۵۹۰c را در نظر بگیرید که از طریق یک تله بخار به اتمسفر یا فشار 0barg تخلیه می شود. مقدار انرژی موجود در یک کیلوگرم کندانس ورودی برابر ۶۷۱KJ می باشد(hr).
این مقدار انرژی طبق قانون اول ترمودینامیک، برابر مقدار انرژی در قسمت ورودی و خروجی تله بخار (فشار بالا و پایین) ثابت است. بنابراین مقدار انرژی آب خروجی تله نیز ۶۷۱KJ خواهد بود.
با نگاه به جدول بخار، مقدار انرژی قابل ذخیره در آب با فشار 0barg برابر ۴۱۹ Kj است و بنابراین مقدار انرژی ۶۷۱-۴۱۹=۲۵۲ kj در خروجی مازاد خواهد بود که نمی تواند بصورت آب وجود داشته باشد.
این مقدار انرژی مقداری از کندانس خروجی را تبخیر می نماید که به بخار فلاش معروف است و از این فرآیند با جوشش آب یا فلاشینگ نام برده می شود.
مقدار بخار فلاش تولیدی در فشار ثانویه (p۲) با استفاده از معادله ۵ ، ۲ ، ۲ قابل محاسبه است:
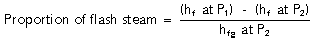
مثال ۳ ، ۲ ، ۲: حالتی که دمای کندانس فشار بالا بیشتر از دمای کندانس فشار پایین است.
آب با فشار ۵barg و دارای ۶۷۱ kj/kg انرژی حرارتی در دمای اشباع ۱۵۹ ۰c می باشد. درصورت کاهش فشار به فشار اتمسفریک (0barg) آب تنها در دمای ۱۰۰ ۰c و با انرژی ۴۱۹ kj/kg وجود خواهد داشت.
تفاوت ۲۵۲ kj/kg در انرژی حرارتی باعث تولید بخار فلاش در فشار اتمسفر می گردد.
در واقع میزان بخار فلاش تولیدی برابر با نسبت مازاد بر انرژی تبخیر فشار ثانویه می باشد.
مثال۴ ، ۲ ، ۲: حالتی که دمای کندانس فشار بالا پایین تر از دمای اشباع فشار پایین است.
همان شرایط مثال ۳ ، ۲ ، ۲ را در نظر بگیرید، فقط فرض نمائید که دمای کندانس فشار بالا برابر ۹۰۰c می باشد. بنابراین آب ورودی زیر دمای اشباع اتمسفریک (۱۰۰c) سرد شده است. (توجه : در عمل معمولا این چنین کاهش دمای زیادی از ۵۹ ۰c1 به ۹۰۰c در مورد کندانس رخ نداده و فقط بمنظور توضیح عدم تشکیل بخار فلاش در این شرایط ذکر می شود.)
با مراجعه به جدول آب، آنتالپی یک کیلوگرم آب در فشار ۵barg و دمای ۹۰۰c برابر ۳۷۷ kj است. از آنجائی که این انرژی کمتر از آنتالپی اشباع یک کیلوگرم آب در فشار اتمسفریک می باشد(۴۱۹ kj )، بنابراین انرژ ی مازادی وجود نداشته و بخار فلاشی حاصل نخواهد شد.
کندانس به راحتی از تله بخار عبور نموده و ضمن تقلیل فشار در همان دما باقی می ماند.
فشار بخار آب در ۹۰۰c برابر۰.۷ barg است.در صورت کاهش بیشتر فشار خروجی کمتر از این مقدار، بخار فلاش مجددا تشکیل می شود.
-اصل تبدیل انرژی و جرم بین دو فرآیند
اصل تبدیل انرژی و جرم اجازه بررسی بخار فلاش را از دیدگاه دیگری بدست می دهد.
شرایط مثال ۳ ، ۲ ، ۲ را در نظر بگیرید که بصورت شماتیک در شکل ۶ ، ۲ ، ۲ نشان داده شده است و جرم کل آن ثابت است.
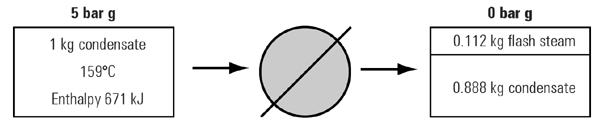
قانون بقای انرژی بیان کننده ثابت ماندن انرژی ورودی و خروجی است و بنابراین مقدار حرارت در بخار فلاش و کندانس در خروجی برابر کندانس ورودی است(۶۷۱ kj)
از جدول بخار اشباع اطلاعات زیر قابل برداشت است:
بنابراین در فشار اتمسفر خواهیم داشت:
دیده می شود که قانون بقای انرژی صادق می باشد.
حقایق دیگ بخار
آیا می دانید که یک کیلوگرم آب در ۱۰۰ درجه سانتیگراد وقتی به فاز گازی یا بخار تبدیل می شود و در فشار اتمسفر چه حجمی بر اساس متر مکعب را اشغال می کند؟
وقتی که یک کیلوگرم (یا یک لیتر آب) ، در دمای ۱۰۰ درجه و فشار و تحت شرایط یکسان تبدیل به بخار می گردد، حجم ایجاد شده توسط آن ۱.۶۶ متر مکعب خواهد بود.
این مقدار که تقریبا ۱۶۰۰ بار افزایش در حجم است سبب ایجاد یک انتشار ناگهانی در فضا است که می تواند سبب تولید یک انرژی بسیار زیاد گردد.
بهتر است ابتدا درک بهتری از بخار پیدا کنیم و ببینیم بخار چیست؟
چگونه می توانیم از بخار استفاده کنیم؟
چه عاملی بخار را بهتر از انواع دیگر مایعات برای حمل و نقل گرما تبدیل نموده است؟
بخارچیست
می دانیم مولکول های آب مانند تمام مواد دیگر در سه حالت وجود دارد، جامد ، مایع و گاز و لذا حالت جامد آب را ما به آن یخ می گوییم و زمانی که به عنوان یک مایع است به آن آب و هرگاه به عنوان یک گاز باشد به آن می گوییم.
بخار یک گاز نامرئی است که با افزودن انرژی گرمایی به آب در دیگ بخار تولید می گردد و این انرژی باید به اندازه ای کافی باشد که سبب اضافه و بالا بردن درجه حرارت آب تا نقطه جوش گردد.
سپس انرژی داده شده به به آب سبب افزایش درجه حرارت آن نمی شود بلکه سبب تغییر فاز و تولید بخار می گردد، این انرژی اضافی است که مورد نیاز برای ایجاد تغییرات آب جوش به بخار است، گرمای تبخیر و یا گرمای نهان نامیده می شود.
برخی از کاربردهای جالب دیگر از بخار
بخار سبب ایجاد نیروی برای حرکت توربین های بخار در نیروگاه برق می باشند که انرژی خود را از سوخت ذغال سنگ دریافت می کند که در نهایت سبب چرخش و تولید برق می شود.
در آتش سوزی ها پاشش آب سبب تولید بخار شده که در اصل با دریافت انرژی توسط آب از آتش سبب کاهش شعله های آن می گردد.
بخار، در حال حاضر در تعدادی زیادی از صنایع استفاده می شود از جمله صنایع : مواد غذایی، کاغذ، نساجی، کارخانه های شیمیایی، برق، حرارت، حمل و نقل ….
*-اتوکلاو بیمارستان برای ضد عفونی تجهیزات و لوازم
*-پخت غذا به روش توسط تزریق مستقیم بخار ، برای مثال پودرها ، مربا ، میوه ، سس ، و غیره
*- ضدعفونی بطری ها
*-تولید شکلات پخت و پز و شکلات نرم با بخار
*-تولید و ساخت پودر شیر، پنیر و لبنیات با بخار
جهت مشاهده متن کامل مقاله فایل زیر را مشاهده نمایید.